
Arsen trioksida

| |
 | |
| Nama | |
|---|---|
|
Nama IUPAC (sistematis)
Diarsenik trioksida | |
| Nama lain
Arsen(III) oksida
| |
| Penanda | |
|
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChEMBL | |
| ChemSpider |
|
| DrugBank |
|
| Nomor EC | |
| KEGG |
|
|
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
|
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| As2O3 | |
| Massa molar | 197.841 g/mol |
| Penampilan | Padat putih |
| Densitas | 3.74 g/cm3 |
| Titik lebur | 3.122 °C (5.652 °F; 3.395 K) |
| Titik didih | 465 °C (869 °F; 738 K) |
| 20 g/L (25 °C) | |
| Kelarutan | Dapat larut dalam asam encer dan alkali, tidak dapat larut dalam pelarut organik |
| Keasaman (pKa) | 9.2 |
| Struktur | |
| kubik (α)<180 °C monoklinik (β) >180 °C |
|
| Lihat teks | |
| Nol | |
| Termokimia | |
|
Entropi molar standar (S |
? J.K−1.mol−1 |
|
Entalpi pembentukan standar (ΔfH |
−657.4 kJ/mol |
| Farmakologi | |
| Kode ATC | L01XX27 |
| Licence data | |
| Bahaya | |
| Lembar data keselamatan |
|
| Frasa-R |
R45, R28, R34, R50/53 |
| Frasa-S |
S53, S45, S60, S61 |
| Dosis atau konsentrasi letal (LD, LC): | |
|
LD50 (dosis median)
|
14.6 mg/kg (tikus, lewat mulut) |
| Batas imbas kesehatan AS (NIOSH): | |
|
PEL (yang diperbolehkan)
|
[1910.1018] TWA 0.010 mg/m3 |
|
REL (yang direkomendasikan)
|
Ca C 0.002 mg/m3 [15-menit] |
|
IDLH (langsung berbahaya)
|
Ca [5 mg/m3 (sebagai As)] |
| Senyawa terkait | |
|
Anion lain
|
Arsen trisulfida |
|
Kation lainnya
|
Fosfor trioksida Antimon trioksida |
|
Senyawa terkait
|
Arsen pentoksida Asam arsenit |
|
Kecuali dinyatakan lain, data di atas berlaku pada temperatur dan tekanan standar (25 °C [77 °F], 100 kPa). | |
|
| |
| Referensi | |
Arsen trioksida adalah senyawa anorganik dengan rumus kimia As2O3. Setiap tahunnya terdapat sekitar 50.000 ton arsen trioksida yang diproduksi di dunia. Kemudharatan bahan ini masih diperdebatkan karena senyawa arsen sangat beracun.
Produksi dan kemunculan
Arsen trioksida dapat dihasilkan lewat pemrosesan rutin senyawa arsen, termasuk oksidasi (pembakaran) mineral arsenik di udara. Contohnya adalah pembakaran orpimen.
- 2 As2S3 + 9 O2 → 2 As2O3 + 6 SO2
Namun, arsen oksida biasanya muncul sebagai produk sampingan dalam pemrosesan bijih lainnya. Contohnya adalah arsenopirit (ketidakmurnian yang sering muncul pada emas). Pemrosesan mineral ini telah mengakibatkan insiden keracunan.
Di laboratorium, bahan ini disiapkan dengan melakukan hidrolisis arsen triklorida:
- 2 AsCl3 + 3 H2O → As2O3 + 6 HCl
As2O3 muncul secara alami di dalam dua mineral, yaitu arsenolit (kubik) dan klaudetit (monoklinik).
Properti dan reaksi
Arsen trioksida merupakan oksida yang bersifat amfoter, dan larutan arsen trioksida yang berair bersifat layaknya asam lemah. Maka dari itu, bahan ini dapat larut di dalam larutan alkalin untuk menghasilkan arsenit. Bahan ini kurang dapat larut di dalam asam, walaupun asam trioksida dapat larut di dalam asam klorida.
Jika bereaksi dengan HF dan HCl yang anhidrat, bahan ini akan menghasilkan AsF3 atau AsCl3:
- As2O3 + 6 HX → 2 AsX3 + 3 H2O (X = F, Cl)
Bahan ini hanya dapat menghasilkan arsen pentoksida (As2O5) atau asamnya jika bereaksi dengan oksidator yang kuat, seperti ozon, hidrogen peroksida dan asam nitrat:
- 2 HNO3 + As2O3 + 2 H2O → 2 H3AsO4 + N2O3
Reduksi menghasilkan arsen atau arsin (AsH3), tergantung pada kondisinya:
- As2O3 + 6 Zn + 12 HNO3 → 2 AsH3 + 6 Zn(NO3)2 + 3 H2O
Reaksi ini digunakan dalam uji Marsh.
Struktur
Dalam bentuk cair dan gas di bawah suhu 800 °C, rumus arsen trioksida adalah As4O6 dan unsur ini bersifat isostruktural dengan P4O6. Di atas suhu 800 °C As4O6 mengalami disosiasi menjadi As2O3, yang memiliki struktur yang sama dengan N2O3. Terdapat tiga jenis yang diketahui dalam bentuk padat: As4O6 kubik pada suhu tinggi ( > 110 °C) yang mengandung As4O6 molekuler, dan dua bentuk polimerik yang terkait. Polimer-polimernya (keduanya mengalami kristalisasi menjadi kristal monoklinik) memiliki lapisan AsO3 piramidal yang berbagi atom O.
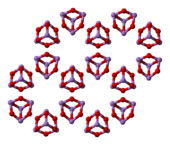
|

|
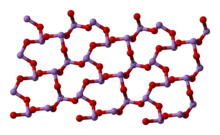
|
(cubic) |
(monoklinik) |
(monoklinik) |