
Febuksostat
| |
|---|---|
| Nama sistematis (IUPAC) | |
|
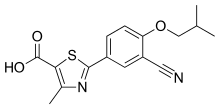
2-(3-cyano-4-isobutoxyphenyl)-4-methyl- 1,3-thiazole-5-carboxylic acid | |
| Data klinis | |
| Nama dagang | Uloric, Adenuric, others |
| AHFS/Drugs.com | monograph |
| MedlinePlus | a609020 |
| Data lisensi | EMA:pranala, US Daily Med:pranala |
| Kat. kehamilan | B1(AU) ?(US) |
| Status hukum | ℞-only (US) |
| Rute | Oral |
| Data farmakokinetik | |
| Ikatan protein | 99.2% pada albumin |
| Metabolisme | via CYP1A1, 1A2, 2C8, 2C9, UGT1A1, 1A8, 1A9 |
| Waktu paruh | ~5–8 jam |
| Ekskresi | Urine (~49%, mayoritas sebagai metabolit, 3% sebagai bentuk obat); feces (~45%, mayoritas sebagai metabolit, 12% as sebagai bentuk obat) |
| Pengenal | |
| Nomor CAS |
144060-53-7 |
| Kode ATC | M04AA03 |
| PubChem | CID 134018 |
| Ligan IUPHAR | 6817 |
| DrugBank | DB04854 |
| ChemSpider |
118173 |
| UNII |
101V0R1N2E |
| KEGG |
D01206 |
| ChEBI | CHEBI:31596 |
| ChEMBL |
CHEMBL1164729 |
| Data kimia | |
| Rumus | C16H16N2O3S |
| SMILES | eMolecules & PubChem |
| |
Febuksostat, dijual dengan nama Uloric di negara-negara benua Amerika dan Adenuric untuk pasar Uni Eropa, adalah obat yang digunakan untuk pengobatan pirai kronis dan hiperurisemia. Febuksostat menghambat enzim xanthine oxidase, sehingga mengurangi produksi asam urat di dalam tubuh. Obat ini biasanya hanya disarankan untuk mereka yang tidak dapat menoleransi alopurinol. Obat ini lebih efektif daripada alopurinol dengan dosis standar, tetapi tidak lebih efektif dari alopurinol dengan dosis tinggi. Namun, obat ini lebih sering menimbulkan kekhawatiran mengenai kematian yang berkaitan dengan jantung bila dibandingkan dengan alopurinol.
Febuksostat diciptakan oleh para ilmuwan dari perusahaan farmasi Jepang yang bernama Teijin pada 1998. Teijin bekerjasama dengan TAP Pharmaceuticals di Amerika Serikat dan Ipsen di [Uni Eropa]]. Ipsen mendapatkan persetujuan sebagai pemasar Febuksostat dari European Medicines Agency pada April 2008, Takeda mendapatkan persetujuan sebagai pemasar dari FDA pada bulan Februari 2009, sedangkan Teijin sendiri memperoleh persetujuan dari Pharmaceuticals and Medical Devices Agency di Jepang pada tahun 2011.
Efek samping yang bisa muncul dari obat ini adalah mual, diare, artralgia, sakit kepala, peningkatan enzin serum hepatik, dan bercan di kulit.