
Magnesium sulfat
 heksahidrat
| |
 Magnesium sulfat anhidrat
| |

Epsomite (heptahidrat)
| |
| Nama | |
|---|---|
|
Nama IUPAC
Magnesium sulfat
| |
| Nama lain
garam epsom (heptahidrat)
| |
| Penanda | |
|
|
|
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChEBI | |
| ChEMBL | |
| ChemSpider |
|
| DrugBank |
|
| Nomor EC | |
|
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
|
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| MgSO4 | |
| Massa molar | 120.366 g/mol (anhidrat) 246.47 g/mol (heptahidrat) |
| Penampilan | padatan kristal putih |
| Bau | tak berbau |
| Densitas | 2.66 g/cm3 (anhidrat) 2.445 g/cm3 (monohidrat) 1.68 g/cm3 (heptahidrat) 1.512 g/cm3 (11-hidrat) |
| Titik lebur | anhidrat terdekomposisi pada 1124 °C monohidrat terdekomposisi pada 200 °C heptahidrat terdekomposisi pada 150 °C undekahidrat terdekomposisi pada 2 °C |
|
anhidrat 26.9 g/100 mL (0 °C) 25.5 g/100 mL (20 °C) heptahidrat 71 g/100 mL (20 °C) |
|
| Kelarutan | 1.16 g/100 mL (18 °C, eter) agak larut pada alkohol, gliserol tidak larut dalam aseton |
| Indeks bias (nD) | 1.523 (monohidrat) 1.433 (heptahidrat) |
| Struktur | |
| monoklinik (hidrat) | |
| Bahaya | |
| Senyawa terkait | |
|
Kation lainnya
|
Berilium sulfat Kalsium sulfat Stronsium sulfat Barium sulfat |
|
Kecuali dinyatakan lain, data di atas berlaku pada temperatur dan tekanan standar (25 °C [77 °F], 100 kPa). | |
|
| |
| Referensi | |
Magnesium sulfat adalah senyawa kimia, suatu garam dengan rumus MgSO4, yang tersusun dari kation magnesium Mg2+ (20,19% b/b) dan anion sulfat SO2−4. Senyawa ini berbentuk kristal padat, yang larut dalam air tetapi tidak larut dalam etanol.
Magnesium sulfat biasanya dijumpai dalam bentuk terhidrasi MgSO4·nH2O, dengan nilai n yang beragam antara 1 dan 11. Bentuk terhidrasinya yang paling umum adalah magnesium sulfat heptahidrat MgSO4·7H2O, yang dikenal sebagai garam inggris (Epsom salt dalam bahasa Inggris), yaitu bahan kimia rumah tangga multiguna, termasuk garam mandi.
Penggunaan utama magnesium sulfat adalah pada bidang pertanian dan kesehatan. Karena kandungannya, MgSO4 berguna memperbaiki tanah yang kekurangan magnesium (suatu zat gizi tanaman esensial karena magnesium berperan penting dalam klorofil dan fotosintesis). Bentuk monohidratnya dipilih untuk penggunaan ini. Pada pertengahan tahun 1970an, produksi tahunannya mencapai 2,3 juta ton per tahun. Bentuk anhidrat dan beberapa hidratnya terjadi di alam sebagai mineral, dan garamnya adalah komponen air yang penting dari beberapa mata air. Bentuk heptahidratnya (dikenal sebagai garam inggris di Indonesia) dipakai untuk campuran air mandi dengan khasiat perawatan tubuh tertentu.
Hidrat
Magnesium sulfat dapat mengkristal sebagai hidratnya, antara lain:
- Anhidrat, MgSO4; tidak stabil di alam, terhidrasi membentuk epsomite.
- Monohidrat, MgSO4·H2O; kieserite, monoklinik.
- MgSO4·1.25H2O atau 8MgSO4·10H2O.
- Dihidrat, MgSO4·2H2O; ortorombik.
- MgSO4·2.5H2O atau 2MgSO4·5H2O.
- Trihidrat, MgSO4·3H2O.
- Tetrahidrat, MgSO4·4H2O; starkeyite, monoklinik.
- Pentahidrat, MgSO4·5H2O; pentahydrite, triklinik.
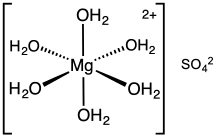
- Heksahidrat, MgSO4·6H2O; hexahydrite, monoklinik.
- Heptahidrat, MgSO4·7H2O ("garam Epsom"); epsomite, ortorombik.
- Eneahidrat, MgSO4·9H2O, monoklinik.
- Dekahidrat, MgSO4·10H2O.
- Undekahidrat, MgSO4·11H2O; meridianiite, triklinik.
Hingga tahun 2017, keberadaan heksahidrat belum dikonfirmasi.
Semua hidratnya akan membebaskan air kristalnya ketika dipanaskan. Di atas suhu 320 °C, hanya bentuk anhidratnya yang stabil. Ia terdekomposisi tanpa meleleh pada 1124 °C membentuk magnesium oksida (MgO) dan belerang trioksida (SO3).
Heptahidrat (garam Epsom)
Heptahidratnya memiliki nama umum "garam Epsom" dari mata air asin yang pahit di Epsom, Surrey, Inggris. Garam tersebut dihasilkan dari mata air yang muncul dari pertemuan kapur berpori North Downs dengan tanah liat London yang kedap air.
Heptahidrat ini mudah kehilangan satu ekivalen air membentuk heksahidrat.
Ini adalah sumber alami magnesium dan belerang. Garam Epsom biasanya digunakan dalam garam mandi, pengelupas, pelemas otot, dan pereda nyeri. Namun, ini berbeda dengan garam Epsom yang digunakan untuk berkebun, karena mengandung aroma dan parfum yang tidak cocok untuk tanaman.
Monohidrat
Monohidratnya dapat dibuat melalui pemanasan heksahidat hingga sekitar 150 °C. Pemanasan lebih lanjut hingga sekitar 300–320 °C menghasilkan magnesium sulfat anhidrat.
Undekahidrat
Magnesium sulfat undekahidrat MgSO4·11H2O, meridianiite, stabil pada tekanan atmosfer pada suhu di bawah 2 °C. Di atas suhu tersebut, ia mencair menjadi campuran heptahidrat padat dan suatu larutan jenuh. Ia memiliki titik eutektik dengan air pada −3,9 °C dan 17,3% (massa) MgSO4.Kristal besar dapat diperoleh dari larutan dengan konsentrasi tertentu yang dijaga pada suhu 0 °C selama beberapa hari.
Pada tekanan sekitar 0,9 GPa dan suhu 240 K, meridianiite terdekomposisi menjadi campuran ice VI dan eneahidrat MgSO4·9H2O.
Eneahidrat
Bentuk eneahidratnya MgSO4·9H2O belum lama diidentifikasi dan dikenali, meskipun terlihat mudah diproduksi (dengan mendinginkan larutan MgSO4 dan natrium sulfat Na2SO4 dengan perbandingan yang sesuai).
Strukturnya adalah monoklinik, dengan parameter sel satuan pada 250 K: a = 0,675 nm, b = 1,195 nm, c = 1,465 nm, β = 95,1°, V = 1,177 nm3 dengan Z = 4. Kelompok ruang yang paling mungkin adalah P21/c. Magnesium selenat juga membentuk eneahidrat MgSeO4·9H2O, tetapi dengan struktur kristal yang berbeda.
Keterjadian di alam
Ion Mg2+ dan SO2−4 masing-masing merupakan kation dan anion terbanyak kedua dalam air laut setelah Na+ dan Cl−, sehingga magnesium sulfat merupakan mineral yang umum dalam lingkungan geologi. Keberadaannya sebagian besar terhubung dengan proses supergen. Beberapa di antaranya juga konstituen yang penting dalam deposit evaporit garam kalium-magnesium (K-Mg).
Titik terang yang teramati oleh pesawat luar angkasa Dawn di Occator Crater pada permukaan planet kate Ceres adalah pantulan cahaya magnesium sulfat heksahidrat yang paling konsisten.
Hampir semua bentuk mineral MgSO4 yang dikenal adalah hidrat. Epsomite adalah analog alami "garam Epsom". Meridianiite, MgSO4·11H2O, telah teramati di permukaan danau beku dan diperkirakan terjadi juga di permukaan Mars. Hexahydrite adalah bentuk hidrat yang lebih rendah (6). Tiga hidrat berikutnya yang lebih rendah—pentahydrite, starkeyite, dan terutama sanderite—jarang dijumpai. Kieserite adalah monohidrat dan jamak dijumpai di antara deposit evaporit. Magnesium sulfat anhidrat dilaporkan dari beberapa tambang batu bara yang terbakar.
Pembuatan
Magnesium sulfat biasanay diperoleh langsung dari lapik danau kering (bahasa Inggris: dry lake bed) dan sumber alami lainnya. Senyawa ini juga dapat dibuat dengan mereaksikan magnesite (magnesium karbonat, MgCO3) atau magnesia (magnesium oksida, MgO) dengan asam sulfat.
Metode lainnya adalah dengan memberi perlakuan air laut atau limbah industri yang mengandung magnesium sehingga membentuk endapan magnesium hidroksida dan mereaksikan endapan tersebut dengan asam sulfat.
Sifat fisik
Relaksasi magnesium sulfat adalah mekanisme utama yang menyebabkan absorpsi suara dalam air laut pada frekuensi di atas 10 kHz (energi akustik diubah menjadi energi termal). Frekuensi yang lebih rendah kurang diserap oleh garam, sehingga bunyi berfrekuensi rendah merambat lebih jauh di lautan. Asam borat dan magnesium karbonat juga memberi kontribusi pada absorpsi.
Garam rangkap
Terdapat garam rangkap yang mengandung magnesium. Ada beberapa yang dikenal sebagai naterium magnesium sulfat dan kalium magnesium sulfat. Campuran tembaga-magnesium sulfat heptahidrat (Mg,Cu)SO4·7H2O baru-baru ini ditemukan terdapat pada tailing tambang dan mineral tersebut diberi nama alspersite.
Penggunaan
Kesehatan
Magnesium sulfat digunakan baik untuk penggunaan bagian luar (sebagai garam inggris alias garam Epsom) maupun penggunaan bagian dalam.
Penggunaan luar terutama untuk formulasi sebagai garam mandi, terutama sebagai perendam kaki untuk meredakan sakit kaki. Mandi dengan cara seperti itu diklaim dapat menenangkan dan mempercepat pemulihan dari nyeri otot, nyeri, atau cedera. Efek kesehatan potensial dari magnesium sulfat tercermin dalam studi medis tentang dampak magnesium pada depresi resisten dan sebagai analgesik untuk migrain dan nyeri kronis. Magnesium sulfat telah dipelajari dalam pengobatan asma,preeklamsia dan eklampsia.
Magnesium sulfat adalah komponen biasa dalam larutan garam pekat yang digunakan dalam tangki isolasi untuk meningkatkan berat jenisnya menjadi sekitar 1,25–1,26. Massa jenisnya yang tinggi ini memungkinkan seseorang untuk mengapung dengan mudah di permukaan air dalam tangki tertutup, menghilangkan sebanyak mungkin indera eksternal.
Di Britania Raya, obat yang mengandung magnesium sulfat dan fenol, yang disebut "drawing paste", berguna untuk bisul kecil atau infeksi lokal dan menghilangkan serpihan.
Untuk pemakaian di bagian dalam, magnesium sulfat dapat diberikan melalui jalur oral, pernapasan, atau intravena. Penggunaan internal termasuk terapi penggantian untuk defisiensi magnesium, pengobatan aritmia akut dan parah, sebagai bronkodilator dalam pengobatan asma, mencegah eklampsia, zat tokolitik, dan sebagai antikonvulsan.
Pertanian
Dalam bidang pertanian, magnesium sulfat digunakan untuk menaikkan kandungan magnesium atau belerang dalam tanah. Paling banyak diaplikasikan terhadap tanaman yang ditanam di pot, atau benih yang rakus magnesium seperti kentang, tomat, wortel, cabai, lemon, dan mawar. Kelebihan magnesium sulfat dibandingkan magnesium pembenah tanah lainnya (seperti dolomit) adalah kelarutannya yang tinggi, sehingga memungkinkan juga sebagai pilihan untuk penyemproan foliar. Larutan magnesium sulfat juga memiliki pH yang hampir netral, dibandingkan dengan garam magnesium yang sedikit alkalis seperti yang dijumpai dalam gamping. Oleh karena itu, penggunaan magnesium sulfat sebagai sumber magnesium untuk tanah tidak mengubah pH tanah secara signifikan. Berlawanan dengan kepercayaan populer bahwa magnesium sulfat mampu mengendalikan hama dan siput, membantu perkecambahan biji, menghasilkan lebih banyak bunga, meningkatkan penyerapan nutrisi, dan ramah lingkungan, tidak ada klaim yang bisa dipertanggungjawabkan kecuali untuk memperbaiki kekurangan magnesium dalam tanah. Magnesium sulfat bahkan dapat mencemari air jika digunakan dalam jumlah berlebihan.
Magnesium sulfat pernah digunakan untuk perawatan akibat keracunan timbal pada manusia sebelum berkembangnya terapi khelasi, dengan harapan bahwa setiap timbal yang tertelan akan mengendap sebagai magnesium sulfat dan terbuang melalui saluran pencernaan. Aplikasi ini banyak digunakan di kalangan dokter hewan pada awal hingga pertengahan abad ke-20. Garam Epsom telah banyak digunakan di banyak lahan pertanian, dan sering digunakan untuk pengobatan hewan ternak yang tidak sengaja menelan timbal.
Preparasi makanan
Magnesium sulfat digunakan sebagai garam penapaian dalam pembuatan bir. Ia juga digunakan sebagai koagulan dalam pembuatan tahu.
Kimia
Magnesium sulfat anhidrat banyak digunakan sebagai desikan dalam sintesis organik yang mengandalkan afinitasnya terhadap air dan kompatibilitasnya terhadap sebagian besar senyawa organik. Selama proses sintesis, fase organik diberi perlakuan dengan magnesium sulfat andhirat. Padatan terhidrasinya kemudian dipisahkan dengan cara filtrasi, dekantasi, atau distilasi (jika titik didihnya cukup rendah). Garam sulfat anorganik lainnya seperti natrium sulfat dan kalsium sulfat dapat juga digunakan dengan cara yang sama.
Konstruksi
Magnesium sulfat digunakan untuk membuat semen tertentu dengan mereaksikan antara magnesium oksida dan larutan magnesium sulfat, yang memiliki kemampuan mengikat yang baik dan lebih tahan daripada semen Portland. Semen ini terutama digunakan dalam produksi panel insulasi ringan. Ketidaktahanannya terhadap air membatasi penggunaannya.
Magnesium (atau natrium) sulfat juga digunakan untuk menguji kekuatan agregat sesuai dengan standar ASTM C88. Pengujian dilakukan dengan perendaman berulang dalam larutan jenuh diikuti dengan pengeringan menggunakan oven untuk mengeringkan garam yang diendapkan dalam ruang berpori yang permeabel. Gaya ekspansi internal, yang berasal dari rehidrasi garam saat pencelupan ulang, menyimulasikan ekspansi air pada pembekuan.
Magnesium sulfat juga digunakan untuk pengjuian ketahanan beton terhadap serangan sulfat eksternal (bahasa Inggris: External Sulfate Attack (ESA)).
Akuarium
Magnesium sulfat heptahidrat juga digunakan untuk mempertahankan konsentrasi magnesium dalam akuarium air laut yang mengandung sejumlah besar batu koral, karena ia mudah habis akibat proses kalsifikasi. Dalam akuarium air laut yang kekurangan magnesium, sulit mengendalikan konsentrasi kalsium dan alkalinitasnya karena tidak cukup magnesium yang ada untuk menstabilkan ion-ion ini dalam air asin dan mencegah pengendapan spontan mereka menjadi kalsium karbonat.
Lihat juga
Pranala luar
|
Garam dan ester ion sulfat
| |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H2SO4 | He | ||||||||||||||||||
| Li2SO4 | BeSO4 | B | Ester ROSO−3 (RO)2SO2 |
(NH4)2SO4 N2H6SO4 (NH3OH)2SO4 |
O | F | Ne | ||||||||||||
|
Na2SO4 NaHSO4 |
MgSO4 |
Al2(SO4)3 Al2SO4(OAc)4 |
Si | P | SO2−4 | Cl | Ar | ||||||||||||
|
K2SO4 KHSO4 |
CaSO4 | Sc2(SO4)3 |
Ti(SO4)2 TiOSO4 |
VSO4 V2(SO4)3 VOSO4 |
CrSO4 Cr2(SO4)3 |
MnSO4 Mn2(SO4)3 |
FeSO4 Fe2(SO4)3 |
CoSO4 Co2(SO4)3 |
NiSO4 |
CuSO4 Cu2SO4 |
ZnSO4 | Ga2(SO4)3 | Ge | As | Se | Br | Kr | ||
|
RbHSO4 Rb2SO4 |
SrSO4 | Y2(SO4)3 | Zr(SO4)2 | Nb | Mo | Tc | Ru | Rh | PdSO4 | Ag2SO4 | CdSO4 | In2(SO4)3 | SnSO4 | Sb2(SO4)3 | Te | I | Xe | ||
| Cs2SO4 | BaSO4 | Hf | Ta | W | Re | Os | Ir | Pt | Au |
Hg2SO4 HgSO4 |
Tl2SO4 Tl2(SO4)3 |
PbSO4 | Bi2(SO4)3 | Po | At | Rn | |||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| La |
Ce2(SO4)3 Ce(SO4)2 |
Pr2(SO4)3 | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb2(SO4)3 | Lu | |||||
| Ac | Th | Pa |
U(SO4)2 UO2SO4 |
Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||||