Radon
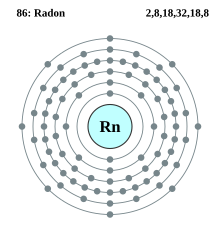 Konfigurasi elektron radon
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Garis spektrum radon
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat umum | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nama, lambang | radon, Rn | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pengucapan | /radon/ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Penampilan | gas tak berwarna | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radon dalam tabel periodik | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nomor atom (Z) | 86 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Golongan | golongan 18 (gas mulia) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Periode | periode 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Blok | blok-p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kategori unsur | gas mulia | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nomor massa | [222] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Konfigurasi elektron | [Xe] 4f14 5d10 6s2 6p6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektron per kelopak | 2, 8, 18, 32, 18, 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat fisik | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase pada STS (0 °C dan 101,325 kPa) | gas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Titik lebur | 202,0 K (−71,15 °C, −96,07 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Titik didih | 211,5 K (−61,7 °C, −79,1 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kepadatan (pada STS) | 9,73 g/L | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| saat cair, pada t.d. | 4,4 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Titik kritis | 377 K, 6,28 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kalor peleburan | 3,247 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kalor penguapan | 18,10 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kapasitas kalor molar | 5R/2 = 20,786 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Tekanan uap
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat atom | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bilangan oksidasi | 0, +2, +6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitas | Skala Pauling: 2,2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energi ionisasi | ke-1: 1037 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jari-jari kovalen | 150 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jari-jari van der Waals | 220 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lain-lain | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kelimpahan alami | dari peluruhan | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Struktur kristal | kubus berpusat muka (fcc) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Konduktivitas termal | 3,61×10−3 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Arah magnet | nonmagnetik | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nomor CAS | 10043-92-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sejarah | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Penemuan | E. Rutherford dan Robert B. Owens (1899) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isolasi pertama | W. Ramsay dan R. Whytlaw-Gray (1910) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotop radon yang utama | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Radon adalah sebuah unsur kimia dengan lambang Rn dan nomor atom 86. Ia adalah sebuah gas mulia yang bersifat radioaktif, tak berwarna, tak berbau, dan tak berasa. Ia terjadi secara alami dalam jumlah kecil sebagai perantara dalam rantai peluruhan radioaktif normal di mana torium dan uranium perlahan-lahan meluruh menjadi berbagai unsur radioaktif berumur pendek dan timbal. Radon sendiri merupakan produk peluruhan langsung dari radium. Isotopnya yang paling stabil, 222Rn, memiliki waktu paruh hanya 3,8 hari, menjadikannya salah satu unsur yang paling langka. Karena torium dan uranium adalah dua unsur radioaktif paling umum di Bumi, juga memiliki tiga isotop dengan waktu paruh beberapa miliar tahun, radon akan ada di Bumi jauh di masa depan meskipun waktu paruhnya singkat. Peluruhan radon menghasilkan banyak nuklida berumur pendek lainnya, yang dikenal sebagai "anak radon", berakhir pada isotop timbal yang stabil.
Tidak seperti semua unsur perantara lainnya dalam rantai peluruhan yang disebutkan di atas, radon, dalam kondisi standar, berbentuk gas dan mudah terhirup, sehingga berbahaya bagi kesehatan. Radon seringkali menjadi kontributor tunggal terbesar untuk dosis radiasi latar seseorang, tetapi karena perbedaan lokal dalam geologi, tingkat paparan gas radon berbeda dari satu tempat ke tempat lain. Sumber yang umum adalah mineral yang mengandung uranium di dalam tanah, dan karena itu ia terakumulasi di area bawah tanah seperti ruang bawah tanah. Radon juga dapat terjadi di beberapa air tanah seperti mata air dan mata air panas.Perubahan iklim dapat menyebabkan radon yang sebelumnya terperangkap di bawah tanah dilepaskan sebagai pencairan ibun abadi, terutama di wilayah seperti Kutub Utara, Alaska, Kanada, Greenland, dan Rusia. Dimungkinkan untuk menguji radon dalam bangunan, dan menggunakan teknik seperti depresurisasi sub-lempengan untuk mitigasi.
Studi epidemiologi telah menunjukkan hubungan yang jelas antara menghirup radon konsentrasi tinggi dan kejadian kanker paru-paru. Radon adalah kontaminan yang mempengaruhi kualitas udara dalam ruangan di seluruh dunia. Menurut Badan Perlindungan Lingkungan Amerika Serikat (EPA), radon adalah penyebab kanker paru-paru kedua yang paling sering, setelah merokok, menyebabkan 21.000 kematian akibat kanker paru-paru per tahun di Amerika Serikat. Sekitar 2.900 kematian ini terjadi di antara orang yang tidak pernah merokok. Walaupun radon adalah penyebab kanker paru-paru kedua yang paling sering, ia adalah penyebab nomor satu di antara nonperokok, menurut perkiraan berorientasi kebijakan EPA. Ketidakpastian yang signifikan ada untuk efek kesehatan dari paparan dosis rendah. Berbeda dengan radon yang berbentuk gas, anak radon berbentuk padat dan menempel pada permukaan, seperti partikel debu di udara, yang dapat menyebabkan kanker paru-paru bila terhirup.
Karakteristik
Sifat fisik
Radon adalah gas yang tak berwarna, tak berbau, dan tak berasa dan karena itu tidak dapat dideteksi oleh indera manusia saja. Pada suhu dan tekanan standar, ia membentuk gas monoatomik dengan kerapatan 9,73 kg/m3, sekitar 8 kali kerapatan atmosfer Bumi di permukaan laut, 1,217 kg/m3. Ia adalah salah satu gas terpadat pada suhu kamar dan merupakan gas mulia terpadat. Meskipun tidak berwarna pada suhu dan tekanan standar, ketika didinginkan di bawah titik bekunya 202 K (−71 °C; −96 °F), ia memancarkan radioluminesensi cemerlang yang berubah dari kuning menjadi jingga-merah saat suhu diturunkan. Setelah kondensasi, ia bersinar karena radiasi intens yang dihasilkannya. Ia sedikit larut dalam air, tetapi lebih larut daripada gas mulia yang lebih ringan. Ia jauh lebih larut dalam cairan organik daripada dalam air. Persamaan kelarutannya adalah sebagai berikut,
di mana 



Sifat kimia
Radon adalah anggota dari unsur-unsur bervalensi nol yang disebut gas mulia, dan secara kimiawi tidak terlalu reaktif. Waktu paruh radon-222 selama 3,8 hari membuatnya berguna dalam ilmu fisika sebagai pelacak alami. Karena radon adalah gas pada kondisi standar, tidak seperti induk rantai peluruhannya, ia dapat dengan mudah diekstrak dari rantai peluruhannya untuk penelitian.
Ia lengai terhadap reaksi kimia yang paling umum, seperti pembakaran, karena kelopak valensi terluarnya mengandung delapan elektron. Ini menghasilkan konfigurasi energi minimum yang stabil di mana elektron terluar terikat erat.Energi ionisasi pertamanya—energi minimum yang diperlukan untuk mengekstraksi satu elektron darinya—adalah 1037 kJ/mol. Sesuai dengan tren periodik, radon memiliki keelektronegatifan yang lebih rendah daripada unsur satu periode sebelumnya, xenon, dan karena itu ia lebih reaktif. Studi awal menyimpulkan bahwa stabilitas radon hidrat harus sama dengan stabilitas hidrat klorin (Cl2) atau belerang dioksida (SO2), dan secara signifikan lebih tinggi daripada stabilitas hidrat hidrogen sulfida (H2S).
Karena biaya dan radioaktivitasnya, penelitian kimia eksperimental jarang dilakukan dengan radon, dan akibatnya sangat sedikit senyawa radon yang dilaporkan, semuanya fluorida atau oksida. Radon dapat dioksidasi oleh oksidator kuat seperti fluorin, sehingga membentuk radon difluorida (RnF2). Ia terurai kembali menjadi unsur-unsurnya pada suhu di atas 523 K (250 °C; 482 °F), dan direduksi oleh air menjadi gas radon dan hidrogen fluorida: ia juga dapat direduksi kembali menjadi unsur-unsurnya oleh gas hidrogen. Ia memiliki volatilitas yang rendah dan dianggap sebagai RnF2. Karena waktu paruh radon yang singkat dan radioaktivitas senyawanya, tidak dimungkinkan untuk mempelajari senyawa tersebut secara detail. Studi teoretis pada molekul ini memprediksi bahwa ia harus memiliki panjang ikatan Rn–F 2,08 ångström (Å), dan bahwa senyawa tersebut secara termodinamika lebih stabil dan kurang mudah menguap daripada rekannya yang lebih ringan xenon difluorida (XeF2).Molekul oktahedral RnF6 diperkirakan memiliki entalpi pembentukan yang lebih rendah daripada radon difluorida.Ion [RnF]+ diyakini terbentuk melalui reaksi berikut:
- Rn (g) + 2 [O2]+[SbF6]− (s) → [RnF]+[Sb2F11]− (s) + 2 O2 (g)
Untuk alasan ini, antimon pentafluorida bersama dengan klorin trifluorida dan N2F2Sb2F11 telah dipertimbangkan untuk penghilangan gas radon di tambang uranium karena pembentukan senyawa radon–fluorin. Senyawa radon dapat dibentuk oleh peluruhan radium dalam radium halida, suatu reaksi yang telah digunakan untuk mengurangi jumlah radon yang terlepas dari target selama penyinaran. Selain itu, garam kation [RnF]+ dengan anion SbF−6, TaF−6, dan BiF−6 telah diketahui. Radon juga dioksidasi oleh dioksigen difluorida menjadi RnF2 pada 173 K (−100 °C; −148 °F).
Radon oksida adalah di antara sedikit senyawa radon yang dilaporkan; hanya trioksida (RnO3) yang telah dikonfirmasi. Fluorida RnF4 dan RnF6 yang lebih tinggi telah diklaim dan dihitung stabil, tetapi identifikasi mereka tidak jelas. Mereka mungkin telah teramati dalam eksperimen di mana produk yang mengandung radon yang tidak diketahui disuling bersama dengan xenon heksafluorida: mereka mungkin RnF4, RnF6, atau keduanya. Pemanasan radon berskala kecil dengan xenon, fluorin, bromin pentafluorida, dan natrium fluorida atau nikel fluorida diklaim menghasilkan fluorida yang lebih tinggi juga yang dihidrolisis menjadi RnO3. Walaupun telah dikemukakan bahwa klaim ini benar adanya karena radon mengendap sebagai kompleks padat [RnF]+2[NiF6]2−, fakta bahwa radon berkopresipitasi dari larutan berair dengan CsXeO3F telah diambil sebagai konfirmasi bahwa RnO3 telah terbentuk, yang telah didukung oleh studi lebih lanjut dari larutan terhidrolisis. [RnO3F]− yang tidak terbentuk pada eksperimen lain mungkin disebabkan tingginya konsentrasi fluorida yang digunakan. Studi elektromigrasi juga menunjukkan adanya bentuk kationik [HRnO3]+ dan anionik [HRnO4]− radon dalam larutan berair berasam lemah (pH > 5), prosedur yang sebelumnya telah divalidasi dengan pemeriksaan xenon trioksida homolog.
Teknik peluruhan juga telah digunakan. Pada tahun 1982, Avrorin dkk. melaporkan bahwa senyawa 212Fr yang dikokristalisasi dengan analog sesiumnya tampak mempertahankan radon yang terikat secara kimiawi setelah penangkapan elektron; analogi dengan xenon memerkirakan pembentukan RnO3, tetapi ini tidak dapat dikonfirmasi.
Tampaknya kesulitan dalam mengidentifikasi fluorida radon yang lebih tinggi berasal dari radon yang secara kinetik terhalang untuk teroksidasi di luar keadaan divalen karena ionisitas radon difluorida (RnF2) yang kuat dan muatan positif yang tinggi pada radon di RnF+; pemisahan spasial molekul RnF2 mungkin diperlukan untuk secara jelas mengidentifikasi fluorida radon yang lebih tinggi, di mana RnF4 diperkirakan lebih stabil daripada RnF6 karena pemisahan spin–orbit dari kulit 6p radon (RnIV akan memiliki konfigurasi kulit tertutup 6s26p21/2). Oleh karena itu, walupun RnF4 harus memiliki stabilitas yang mirip dengan xenon tetrafluorida (XeF4), RnF6 kemungkinan akan jauh lebih tidak stabil daripada xenon heksafluorida (XeF6): radon heksafluorida mungkin juga merupakan molekul oktahedral biasa, tidak seperti struktur oktahedral XeF6, dikarenakan adanya efek pasangan lengai. Karena radon cukup elektropositif untuk gas mulia, ada kemungkinan bahwa radon fluorida benar-benar memiliki struktur jembatan fluorin tinggi dan tidak mudah menguap. Ekstrapolasi ke bawah golongan gas mulia juga menunjukkan kemungkinan keberadaan RnO, RnO2, dan RnOF4, serta klorida gas mulia pertama yang stabil secara kimiawi RnCl2 dan RnCl4, tetapi belum ada dari mereka yang ditemukan.
Radon karbonil (RnCO) telah diprediksi stabil dan memiliki geometri molekul linier. Molekul Rn2 dan RnXe ditemukan secara signifikan terstabilkan oleh kopling spin-orbit. Radon yang dikurung di dalam fulerena telah diusulkan sebagai obat tumor. Walaupun Xe(VIII) ada, tidak ada senyawa Rn(VIII) yang dinyatakan ada; RnF8 seharusnya sangat tidak stabil secara kimiawi (XeF8 tidak stabil secara termodinamika). Diperkirakan bahwa senyawa Rn(VIII) yang paling stabil adalah barium peradonat (Ba2RnO6), analog dengan barium perxenat. Ketidakstabilan Rn(VIII) disebabkan oleh stabilisasi relativistik kulit 6s, juga dikenal sebagai efek pasangan lengai.
Radon bereaksi dengan cairan halogen fluorida ClF, ClF3, ClF5, BrF3, BrF5, dan IF7 untuk membentuk RnF2. Dalam larutan halogen fluorida, radon tidak mudah menguap dan ada sebagai kation RnF+ dan Rn2+; penambahan anion fluorida menghasilkan pembentukan kompleks RnF−3 dan RnF2−4, sejajar dengan sifat kimia berilium(II) dan aluminium(III).Potensial elektroda standar dari pasangan Rn2+/Rn telah diperkirakan sebesar +2,0 V, meskipun tidak ada bukti pembentukan ion atau senyawa radon yang stabil dalam larutan berair.
Isotop
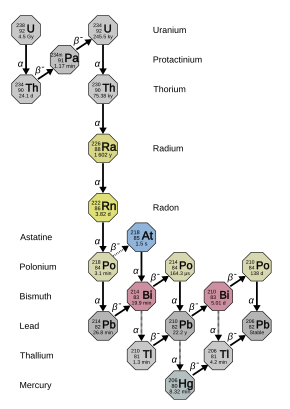
Radon tidak memiliki isotop stabil. Tiga puluh sembilan isotop radioaktif telah dikarakterisasi, dengan massa atom mulai dari 193 hingga 231. Isotop yang paling stabil adalah 222Rn, yang merupakan produk peluruhan dari 226Ra, sebuah produk peluruhan dari 238U. Sejumlah kecil isotop 218Rn (yang sangat tidak stabil) juga ada di antara turunan 222Rn.
Tiga isotop radon lainnya memiliki waktu paruh lebih dari satu jam: 211Rn, 210Rn dan 224Rn. Isotop 220Rn adalah produk peluruhan alami dari isotop torium (thorium) yang paling stabil (232Th), dan umumnya disebut sebagai "toron" (thoron). Ia memiliki waktu paruh 55,6 detik dan juga memancarkan radiasi alfa. Demikian pula, 219Rn diturunkan dari isotop aktinium (actinium) yang paling stabil (227Ac)—dinamai "aktinon" (actinon)—dan merupakan pemancar alfa dengan waktu paruh 3,96 detik. Tidak ada isotop radon yang terjadi secara signifikan dalam deret peluruhan neptunium (237Np), meskipun sejumlah kecil isotop 217Rn (yang sangat-sangat tidak stabil) terproduksi.
Produk peluruhan
222Rn termasuk dalam rantai peluruhan radium dan uranium-238, dan memiliki waktu paruh 3,8235 hari. Empat produk pertamanya (tidak termasuk skema peluruhan marjinal) berumur sangat pendek, yang berarti bahwa disintegrasi yang sesuai menunjukkan distribusi radon awal. Peluruhannya melalui urutan berikut:
- 222Rn, 3,82 hari, meluruh melalui peluruhan alfa menjadi...
- 218Po, 3,10 menit, meluruh melalui peluruhan alfa menjadi...
- 214Pb, 26,8 menit, meluruh melalui peluruhan beta menjadi...
- 214Bi, 19,9 menit, meluruh melalui peluruhan beta menjadi...
- 214Po, 0,1643 ms, meluruh melalui peluruhan alfa menjadi...
- 210Pb, yang memiliki waktu paruh lebih lama yaitu 22,3 tahun, meluruh melalui peluruhan beta menjadi...
- 210Bi, 5,013 hari, meluruh melalui peluruhan beta menjadi...
- 210Po, 138,376 hari, meluruh melalui peluruhan alfa menjadi...
- 206Pb, stabil.
Faktor kesetimbangan radon adalah rasio antara aktivitas semua progeni radon periode pendek (yang bertanggung jawab atas sebagian besar efek biologis radon), dan aktivitas yang akan berada pada kesetimbangan dengan induk radon.
Jika volume tertutup terus-menerus disuplai dengan radon, konsentrasi isotop berumur pendek akan meningkat sampai tercapai kesetimbangan di mana laju peluruhan setiap produk peluruhan akan sama dengan laju peluruhan radon itu sendiri. Faktor kesetimbangan adalah 1 ketika kedua aktivitas bernilai sama, yang berarti bahwa produk peluruhan telah berada cukup dekat dengan induk radon untuk mencapai kesetimbangan, dalam beberapa jam. Dalam kondisi ini, setiap tambahan pCi/L radon akan meningkatkan paparan sebesar 0,01 working level (WL, ukuran radioaktivitas yang biasa digunakan di pertambangan). Kondisi ini tidak selalu terpenuhi; di banyak rumah, faktor kesetimbangan biasanya 40%; yaitu, akan ada 0,004 WL produk peluruhan untuk setiap pCi/L radon di udara.210Pb membutuhkan waktu lebih lama (puluhan tahun) untuk mencapai kesetimbangan dengan radon, tetapi, jika lingkungan mengizinkan akumulasi debu dalam jangka waktu yang lama, 210Pb dan produk peluruhannya juga dapat berkontribusi pada tingkat radiasi secara keseluruhan.
Karena muatan elektrostatisnya, progeni radon menempel pada permukaan atau partikel debu, sedangkan gas radon tidak. Keterikatan menghilangkannya dari udara, biasanya menyebabkan faktor kesetimbangan di atmosfer menjadi kurang dari 1. Faktor kesetimbangan juga diturunkan oleh sirkulasi udara atau perangkat penyaringan udara, dan ditingkatkan oleh partikel debu di udara, termasuk asap rokok. Faktor kesetimbangan yang ditemukan dalam studi epidemiologi adalah 0,4.
Sejarah dan etimologi
Radon adalah unsur radioaktif kelima yang ditemukan, pada tahun 1899 oleh E. Rutherford dan Robert B. Owens di Universitas McGill di Montreal, setelah uranium, torium, radium, dan polonium. Pada tahun 1899, P. dan M. Curie mengamati bahwa gas yang dipancarkan oleh radium tetap bersifat radioaktif selama satu bulan. Di tahun itu juga, Rutherford dan Owens memperhatikan variasi ketika mencoba mengukur radiasi dari torium oksida. Rutherford memperhatikan bahwa senyawa torium terus-menerus memancarkan gas radioaktif yang tetap radioaktif selama beberapa menit, dan menyebut gas ini "emanasi" (emanation, dari bahasa Latin: emanare, mengalir keluar, dan emanatio, ekspirasi), dan kemudian "emanasi torium" (thorium emanation, "Th Em"). Pada tahun 1900, Friedrich E. Dorn melaporkan beberapa percobaan di mana ia melihat bahwa senyawa radium memancarkan gas radioaktif yang ia beri nama "emanasi radium" (radium emanation, "Ra Em"). Pada tahun 1901, Rutherford dan H. Brooks mendemonstrasikan bahwa emanasi tersebut bersifat radioaktif, tetapi mengkreditkan Curie atas penemuan unsur tersebut. Pada tahun 1903, emanasi serupa teramati dari aktinium oleh A. Debierne, dan disebut "emanasi aktinium" (actinium emanation, "Ac Em").
Beberapa nama pendek segera diusulkan untuk tiga emanasi ini: exradio, exthorio, dan exactinio pada tahun 1904;radon (Ro), thoron (To), dan akton atau acton (Ao) pada tahun 1918;radeon, thoreon, dan actineon pada tahun 1919, dan akhirnya radon, thoron, dan actinon pada tahun 1920. (Nama radon tidak berhubungan dengan nama matematikawan Austria J. Radon.) Kemiripan spektrum ketiga gas ini dengan argon, kripton, dan xenon, dan inersia kimia yang teramati membuat Sir W. Ramsay memperkirakan bahwa "emanasi" mungkin mengandung sebuah unsur baru dari keluarga gas mulia, pada tahun 1904.
Pada awal abad ke-20 di A.S., emas yang terkontaminasi anak radon 210Pb memasuki industri perhiasan. Ini berasal dari biji emas yang mengandung 222Rn yang telah dilebur setelah radon meluruh.
Pada tahun 1909, Ramsay dan R. Whytlaw-Gray mengisolasi radon dan menentukan titik lebur dan kerapatannya. Pada tahun 1910, mereka menentukan bahwa itu adalah gas terberat yang diketahui. Mereka menulis bahwa "L'expression l'émanation du radium est fort incommode" (""ekspresi 'emanasi radium' sangatlah canggung") dan menyarankan nama baru niton (Nt) (dari bahasa Latin: nitens, bersinar) untuk menekankan sifat radioluminesensinya, dan pada tahun 1912 nama itu diterima oleh Komisi Internasional untuk Berat Atom. Pada tahun 1923, Komite Internasional untuk Unsur Kimia dan Persatuan Kimia Murni dan Terapan Internasional (IUPAC) memilih di antara nama radon (Rn), toron (Tn), dan aktinon (An). Kemudian, ketika isotop diberi nomor alih-alih diberi nama, unsur tersebut mengambil nama isotop paling stabil, radon, sedangkan Tn diganti namanya menjadi 220Rn dan An diganti menjadi 219Rn. Hal ini menyebabkan beberapa kebingungan dalam literatur mengenai penemuan unsur tersebut, dan walaupun Dorn telah menemukan isotop radon, dia bukanlah orang pertama yang menemukan unsur radon.
Sampai tahun 1960-an, unsur ini juga disebut sebagai emanasi (emanation). Senyawa radon pertama yang disintesis, radon fluorida, diperoleh pada tahun 1962. Bahkan saat ini, kata radon dapat mengacu pada unsur itu sendiri atau isotopnya 222Rn, dengan toron tetap digunakan sebagai nama pendek untuk 220Rn untuk membendung ambiguitas ini. Nama aktinon untuk 219Rn jarang ditemui saat ini, mungkin karena waktu paruh isotop tersebut yang pendek.
Bahaya paparan radon yang tinggi di pertambangan, dimana paparannya bisa mencapai 1.000.000 Bq/m3, sudah lama diketahui. Pada tahun 1530, Paracelsus mendeskripsikan penyakit yang diderita para penambang, mala metallorum, dan G. Agricola merekomendasikan ventilasi di tambang untuk menghindari penyakit gunung ini (Bergsucht). Pada tahun 1879, kondisi ini diidentifikasi sebagai kanker paru-paru oleh Harting dan Hesse dalam penyelidikan mereka terhadap penambang dari Schneeberg, Jerman. Studi besar pertama dengan radon dan kesehatan terjadi dalam konteks penambangan uranium di wilayah Joachimsthal di Bohemia. Di A.S., studi dan mitigasi hanya mengikuti beberapa dekade efek kesehatan pada penambang uranium di A.S. Barat Daya yang dipekerjakan selama awal Perang Dingin; standar tidak diterapkan hingga tahun 1971.
Kehadiran radon di udara dalam ruangan telah didokumentasikan sejak tahun 1950. Mulai tahun 1970-an, penelitian dimulai untuk membahas sumber radon dalam ruangan, penentu konsentrasi, efek kesehatan, dan pendekatan mitigasi. Di A.S., masalah radon dalam ruangan mendapat publisitas luas dan penyelidikan intensif setelah insiden yang dipublikasikan secara luas pada tahun 1984. Selama pemantauan rutin di pembangkit listrik tenaga nuklir Pennsylvania, seorang pekerja ditemukan terkontaminasi radioaktivitas. Konsentrasi radon yang tinggi di rumahnya kemudian diidentifikasi sebagai penyebabnya.
Keterjadian
Satuan konsentrasi
Semua pembahasan tentang konsentrasi radon di lingkungan mengacu pada 222Rn. Walaupun laju produksi rata-rata 220Rn (dari deret peluruhan torium) hampir sama dengan 222Rn, jumlah 220Rn di lingkungan jauh lebih sedikit daripada 222Rn karena waktu paruh 220Rn yang pendek (55 detik, versus 3,8 hari).
Konsentrasi radon di atmosfer biasanya diukur dalam becquerel per meter kubik (Bq/m3), satuan turunan SI. Satuan pengukuran lain yang umum di A.S. adalah pikocurie per liter (pCi/L); 1 pCi/L = 37 Bq/m3. Eksposur rumah tangga biasa rata-rata sekitar 48 Bq/m3 di dalam ruangan, meskipun ini sangat bervariasi, dan 15 Bq/m3 di luar ruangan.
Dalam industri pertambangan, eksposur biasanya diukur dalam working level (WL), dan paparan kumulatif dalam working level month (WLM); 1 WL sama dengan setiap kombinasi anak 222Rn yang berumur pendek (218Po, 214Pb, 214Bi, dan 214Po) dalam 1 liter udara yang melepaskan 1,3 × 105 MeV energi alfa potensial; 1 WL setara dengan 2,08 × 10−5 joule per meter kubik udara (J/m3). Satuan SI dari paparan kumulatif dinyatakan dalam joule-jam per meter kubik (J·h/m3). Satu WLM setara dengan 3,6 × 10−3 J·h/m3. Paparan 1 WL selama 1 bulan kerja (170 jam) sama dengan 1 WLM. Paparan kumulatif 1 WLM kira-kira setara dengan hidup satu tahun di atmosfer dengan konsentrasi radon 230 Bq/m3.
222Rn meluruh menjadi 210Pb dan radioisotop lainnya. Tingkat 210Pb dapat diukur. Laju pengendapan radioisotop ini bergantung pada cuaca.
Konsentrasi radon yang ditemukan di lingkungan alami terlalu rendah untuk dideteksi dengan cara kimia. Konsentrasi 1.000 Bq/m3 (relatif tinggi) setara dengan 0,17 pikogram per meter kubik (pg/m3). Konsentrasi rata-rata radon di atmosfer adalah sekitar 6×10−18persen molar, atau sekitar 150 atom dalam setiap mililiter udara. Aktivitas radon di seluruh atmosfer Bumi berasal dari hanya beberapa puluh gram radon, yang secara konsisten digantikan oleh peluruhan radium, torium, dan uranium dalam jumlah yang lebih besar.
Alam
Radon diproduksi oleh peluruhan radioaktif radium-226, yang ditemukan dalam bijih uranium, batuan fosfat, batuan serpih, batuan beku dan metamorf seperti granit, gneis, dan sekis, dan pada tingkat yang lebih rendah, pada batuan biasa seperti batu gamping. Setiap mil persegi permukaan tanah, hingga kedalaman 6 inci (2,6 km2 hingga kedalaman 15 cm), mengandung kira-kira 1 gram radium, yang melepaskan radon dalam jumlah kecil ke atmosfer. Dalam skala global, diperkirakan 2,4 miliar curie (90 EBq) radon dilepaskan dari tanah setiap tahunnya. Ini setara dengan sekitar 15,3 kilogram (34 pon).
Konsentrasi radon dapat sangat berbeda dari satu tempat ke tempat lain. Di udara terbuka, berkisar antara 100 Bq/m3, bahkan lebih sedikit (0,1 Bq/m3) di atas lautan. Di gua atau tambang berventilasi, atau rumah dengan ventilasi buruk, konsentrasinya naik menjadi 20–2.000 Bq/m3.
Konsentrasi radon bisa jauh lebih tinggi dalam konteks pertambangan. Peraturan ventilasi menginstruksikan untuk menjaga konsentrasi radon di tambang uranium di bawah "working level", dengan tingkat persentil ke-95 berkisar hingga hampir 3 WL (546 pCi 222Rn per liter udara; 20,2 kBq/m3, diukur dari tahun 1976 hingga 1985). Konsentrasi di udara pada Gastein Healing Gallery (tanpa ventilasi) rata-rata 43 kBq/m3 (1,2 nCi/L) dengan nilai maksimal 160 kBq/m3 (4,3 nCi/L).
Radon sebagian besar muncul dengan rantai peluruhan deret radium dan uranium (222Rn), dan sedikit dengan deret torium (220Rn). Unsur tersebut berasal secara alami dari tanah, dan beberapa bahan bangunan, di seluruh dunia, di mana pun jejak uranium atau torium ditemukan, dan khususnya di daerah dengan tanah yang mengandung granit atau batu serpih, yang memiliki konsentrasi uranium lebih tinggi. Tidak semua daerah granit rentan terhadap emisi radon yang tinggi. Menjadi gas langka, ia biasanya bermigrasi dengan bebas melalui patahan dan tanah yang terfragmentasi, dan dapat terakumulasi di gua atau air. Karena waktu paruhnya yang sangat pendek (empat hari untuk 222Rn), konsentrasi radon menurun sangat cepat ketika jarak dari area produksi meningkat. Konsentrasi radon sangat bervariasi dengan musim dan kondisi atmosfer. Misalnya, telah terbukti bahwa ia terakumulasi di udara jika ada inversi meteorologi dan sedikit angin.
Konsentrasi radon yang tinggi dapat ditemukan di beberapa mata air dan mata air panas. Kota Boulder, Montana; Misasa, Jepang; Bad Kreuznach, Jerman; dan negara Jepang memiliki mata air kaya radium yang memancarkan radon. Untuk diklasifikasikan sebagai air mineral radon, konsentrasi radon harus di atas 2 nCi/L (74 kBq/m3). Aktivitas air mineral radon mencapai 2.000 kBq/m3 di Merano dan 4.000 kBq/m3 di Lurisia (Italia).
Konsentrasi radon alami di atmosfer Bumi sangatlah rendah sehingga air kaya radon yang bersentuhan dengan atmosfer akan terus kehilangan radon melalui penguapan. Oleh karena itu, air tanah memiliki konsentrasi 222Rn yang lebih tinggi daripada air permukaan, karena radon terus menerus diproduksi oleh peluruhan radioaktif 226Ra yang terdapat dalam batuan. Demikian pula, zona jenuh suatu tanah seringkali memiliki kandungan radon yang lebih tinggi daripada zona tak jenuh karena kehilangan difusi ke atmosfer.
Pada tahun 1971, Apollo 15 melewati 110 km (68 mi) di atas dataran tinggi Aristarchus di Bulan, dan mendeteksi peningkatan signifikan partikel alfa yang diperkirakan disebabkan oleh peluruhan 222Rn. Kehadiran 222Rn telah disimpulkan kemudian dari data yang diperoleh dari spektrometer partikel alfa Lunar Prospector.
Radon ditemukan di beberapa minyak bumi. Karena radon memiliki kurva tekanan dan suhu yang mirip dengan propana, dan kilang minyak memisahkan petrokimia berdasarkan titik didihnya, pipa yang membawa propana yang baru dipisahkan di kilang minyak dapat terkontaminasi karena peluruhan radon dan produknya.
Residu dari industri minyak bumi dan gas alam sering mengandung radium dan turunannya. Kerak sulfat dari sumur minyak bisa kaya akan radium, sedangkan air, minyak, dan gas dari sumur sering kali mengandung radon. Radon meluruh membentuk radioisotop padat yang membentuk lapisan di bagian dalam pipa.
Akumulasi pada bangunan
Konsentrasi radon yang tinggi di rumah-rumah ditemukan secara kebetulan pada tahun 1985 setelah pengujian radiasi ketat yang dilakukan di pembangkit listrik tenaga nuklir Limerick Generating Station mengungkapkan bahwa Stanley Watras, seorang insinyur konstruksi di pabrik tersebut, terkontaminasi oleh zat radioaktif meskipun reaktornya tidak pernah diisi bahan bakar. Paparan rumah tangga tipikal adalah sekitar 100 Bq/m3 (2.7 pCi/L) di dalam ruangan. Beberapa tingkat radon akan ditemukan di semua bangunan. Radon sebagian besar memasuki bangunan langsung dari tanah melalui level terendah di bangunan yang bersentuhan dengan tanah. Tingkat radon yang tinggi dalam suplai air juga dapat meningkatkan tingkat radon di udara dalam ruangan. Titik masuk tipikal radon ke dalam bangunan adalah retakan pada fondasi dan dinding yang kokoh, sambungan konstruksi, celah di lantai gantung dan di sekitar pipa servis, rongga di dalam dinding, dan suplai air. Konsentrasi radon di tempat yang sama dapat berbeda dua kali lipat/setengah selama satu jam. Selain itu, konsentrasi di satu ruangan dalam sebuah bangunan mungkin berbeda secara signifikan dengan konsentrasi di ruangan yang bersebelahan. Karakteristik tanah tempat tinggal adalah sumber radon yang paling penting untuk lantai dasar dan konsentrasi radon dalam ruangan yang lebih tinggi teramati di lantai bawah. Sebagian besar konsentrasi radon yang tinggi telah dilaporkan dari tempat-tempat di dekat zona patahan; maka keberadaan hubungan antara tingkat ekshalasi dari patahan dan konsentrasi radon dalam ruangan jelas adanya.
Distribusi konsentrasi radon umumnya akan berbeda dari ruangan ke ruangan, dan pembacaannya dirata-ratakan sesuai dengan protokol peraturan. Konsentrasi radon dalam ruangan biasanya diasumsikan mengikuti distribusi log-normal pada wilayah tertentu. Dengan demikian, rata-rata geometrik umumnya digunakan untuk memperkirakan konsentrasi radon "rata-rata" di suatu area.
Konsentrasi rata-rata berkisar dari kurang dari 10 Bq/m3 hingga lebih dari 100 Bq/m3 di beberapa negara Eropa.Simpangan baku geometrik tipikal yang ditemukan dalam penelitian berkisar antara 2 dan 3, yang berarti (diberikan aturan 68–95–99,7) bahwa konsentrasi radon diperkirakan lebih dari seratus kali konsentrasi rata-rata untuk 2% hingga 3% kasus.
Beberapa bahaya radon tertinggi di A.S. ditemukan di Iowa dan di daerah Pegunungan Appalachia di tenggara Pennsylvania. Iowa memiliki konsentrasi radon rata-rata tertinggi di A.S. karena glasiasi signifikan yang menggiling batuan granit dari Perisai Kanada dan menyimpannya sebagai tanah yang membentuk tanah pertanian Iowa yang kaya. Banyak kota di Iowa, seperti Kota Iowa, telah melewati persyaratan untuk konstruksi tahan radon di rumah baru. Pembacaan tertinggi kedua di Irlandia ditemukan di gedung perkantoran di kota Mallow, County Cork, mendorong ketakutan lokal mengenai kanker paru-paru.
Di beberapa tempat, tailing uranium telah digunakan untuk tempat pembuangan sampah dan kemudian dibangun di atasnya, yang mengakibatkan kemungkinan peningkatan paparan radon.
Karena radon adalah gas yang tak berwarna dan tak berbau, satu-satunya cara untuk mengetahui berapa banyak radon yang ada di udara atau air adalah dengan melakukan pengujian. Di A.S., kit uji radon tersedia untuk umum di toko ritel, seperti toko perangkat keras, untuk digunakan di rumah, dan pengujian tersedia melalui profesional berlisensi, yang seringkali merupakan inspektur rumah. Upaya untuk menurunkan kadar radon dalam ruangan disebut mitigasi radon. Di A.S., EPA merekomendasikan semua rumah untuk diuji radon. Di Britania Raya di bawah Housing Health & Safety Rating System (HHSRS) pemilik properti memiliki kewajiban untuk mengevaluasi potensi risiko dan bahaya terhadap kesehatan dan keselamatan di properti hunian.
Produksi industri
Radon diperoleh sebagai produk sampingan dari pengolahan bijih uranifero setelah dipindahkan ke dalam larutan 1% asam klorida atau bromida. Campuran gas yang diekstraksi dari larutan mengandung H2, O2, He, Rn, CO2, H2O dan hidrokarbon. Campuran tersebut dimurnikan dengan melewatkannya di atas tembaga pada 993 K (720 °C; 1.328 °F) untuk menghilangkan H2 dan O2, kemudian KOH dan P2O5 digunakan untuk menghilangkan asam dan uap air melalui sorpsi. Radon dikondensasikan oleh nitrogen cair dan dimurnikan dari gas residu melalui sublimasi.
Komersialisasi radon telah diatur, tetapi ia tersedia dalam jumlah kecil untuk kalibrasi sistem pengukuran 222Rn, dengan harga, pada tahun 2008, hampir US$6.000 ($6.982 tahun 2023) per mililiter larutan radium (yang hanya berisi sekitar 15 pikogram radon aktual pada saat tertentu). Radon diproduksi oleh larutan radium-226 (waktu paruh 1.600 tahun). Radium-226 meluruh melalui emisi partikel alfa, menghasilkan radon yang terkumpul di atas sampel radium-226 dengan laju sekitar 1 mm3/hari per gram radium; kesetimbangan tercapai dengan cepat dan radon diproduksi dalam aliran yang stabil, dengan aktivitas yang sama dengan radium (50 Bq). Gas 222Rn (waktu paruh sekitar empat hari) keluar dari kapsul melalui difusi.
Skala konsentrasi
| Bq/m3 | pCi/L | Contoh keterjadian |
|---|---|---|
| 1 | ~0,027 | Konsentrasi radon di tepi lautan besar biasanya 1 Bq/m3.
Konsentrasi jejak radon di atas lautan atau di Antarktika bisa lebih rendah dari 0,1 Bq/m3. |
| 10 | 0,27 | Rata-rata konsentrasi benua di udara terbuka: 10 hingga 30 Bq/m3.
Berdasarkan serangkaian survei, konsentrasi radon dalam ruangan rata-rata global diperkirakan sebesar 39 Bq/m3. |
| 100 | 2,7 | Paparan domestik dalam ruangan tipikal. Sebagian besar negara telah mengadopsi konsentrasi radon 200–400 Bq/m3 untuk udara dalam ruangan sebagai Tingkat Tindakan atau Referensi. Jika pengujian menunjukkan tingkat kurang dari 4 pikocurie radon per liter udara (150 Bq/m3), maka tidak diperlukan tindakan apa pun. Paparan terakumulasi 230 Bq/m3 konsentrasi gas radon selama periode 1 tahun sesuai dengan 1 WLM. |
| 1.000 | 27 | Konsentrasi radon yang sangat tinggi (>1000 Bq/m3) ditemukan pada rumah yang dibangun di atas tanah dengan kandungan uranium yang tinggi dan/atau permeabilitas tanah yang tinggi. Jika kadar radon 20 pikocurie per liter udara (800 Bq/m3) atau lebih tinggi, pemilik rumah harus mempertimbangkan beberapa jenis prosedur untuk menurunkan kadar radon dalam ruangan. Konsentrasi yang diizinkan di tambang uranium adalah sekitar 1.220 Bq/m3 (33 pCi/L) |
| 10.000 | 270 | Konsentrasi di udara pada Gastein Healing Gallery (tanpa ventilasi) rata-rata 43 kBq/m3 (sekitar 1,2 nCi/L) dengan nilai maksimal 160 kBq/m3 (sekitar 4,3 nCi/L). |
| 100.000 | ~2700 | Sekitar 100.000 Bq/m3 (2,7 nCi/L) terukur di ruang bawah tanah Stanley Watras. |
| 1.000.000 | 27000 | Konsentrasi mencapai 1.000.000 Bq/m3 dapat ditemukan di tambang uranium yang tidak berventilasi. |
| ~5,54 × 1019 | ~1,5 × 1018 | Batas atas teoretis: Gas radon (222Rn) pada konsentrasi 100% (1 atmosfer, 0 °C); 1,538×105 curie/gram; 5,54×1019 Bq/m3. |
Aplikasi
Medis
Bentuk perdukunan awal abad ke-20 adalah pengobatan penyakit dalam radiotorium. Itu adalah ruangan kecil yang tertutup bagi pasien agar terpapar radon karena "efek obat"-nya. Sifat karsinogenik radon karena radiasi pengionnya menjadi jelas kemudian. Radioaktivitas perusak molekul radon telah digunakan untuk membunuh sel kanker, tetapi tidak meningkatkan kesehatan sel sehat. Radiasi pengion menyebabkan pembentukan radikal bebas, yang mengakibatkan kerusakan sel, menyebabkan peningkatan angka penyakit, termasuk kanker.
Paparan radon telah disarankan untuk mengurangi penyakit autoimun seperti artritis dalam proses yang dikenal sebagai radiasi hormesis. Akibatnya, pada akhir abad ke-20 dan awal abad ke-21, "tambang kesehatan" didirikan di Basin, Montana, menarik perhatian orang yang mencari bantuan dari masalah kesehatan seperti artritis melalui paparan terbatas terhadap air tambang radioaktif dan radon. Praktik ini tidak disarankan karena efek buruk radiasi dosis tinggi yang terdokumentasi dengan baik pada tubuh.
Pemandian air radioaktif telah diterapkan sejak tahun 1906 di Jáchymov, Republik Ceko, tetapi bahkan sebelum penemuan radon telah digunakan di Bad Gastein, Austria. Mata air yang kaya radium juga digunakan pada onsen tradisional Jepang di Misasa, Prefektur Tottori. Terapi minum diterapkan di Bad Brambach, Jerman, dan selama awal abad ke-20, air dari mata air dengan radon di dalamnya dibotolkan dan dijual (air ini mengandung sedikit atau tidak ada radon di dalamnya pada saat sampai ke konsumen karena waktu paruh radon yang pendek). Terapi inhalasi dilakukan di Gasteiner-Heilstollen, Austria; Świeradów-Zdrój, Czerniawa-Zdrój, Kowary, Lądek Zdrój, Polandia; Harghita Băi, Romania; dan Boulder, Montana. Di A.S. dan Eropa, ada beberapa "spa radon", di mana orang duduk selama beberapa menit atau jam dalam suasana radon tinggi, seperti di Bad Schmiedeberg, Jerman.
Radon telah diproduksi secara komersial untuk digunakan dalam terapi radiasi, tetapi sebagian besar telah digantikan oleh radionuklida yang dibuat dalam akselerator partikel dan reaktor nuklir. Radon telah digunakan dalam biji implan, terbuat dari emas atau kaca, terutama digunakan untuk mengobati kanker, yang dikenal sebagai brakiterapi. Biji emas diproduksi dengan mengisi tabung panjang dengan radon yang dipompa dari sumber radium, tabung tersebut kemudian dibagi menjadi bagian-bagian pendek dengan cara dikerutkan dan dipotong. Lapisan emas menahan radon di dalam, dan menyaring radiasi alfa dan beta, sambil membiarkan sinar gama keluar (yang membunuh jaringan yang sakit). Aktivitas ini dapat berkisar dari 0,05 hingga 5 milicurie per benih (2 hingga 200 MBq). Sinar gama dihasilkan oleh radon dan unsur berumur pendek pertama dari rantai peluruhannya (218Po, 214Pb, 214Bi, 214Po).
Setelah 11 waktu paruh (42 hari), radioaktivitas radon berada pada 1/2.048 dari tingkat awalnya. Pada tahap ini, aktivitas residu utama benih berasal dari produk peluruhan radon 210Pb, yang waktu paruhnya (22,3 tahun) 2.000 kali lipat radon dan keturunannya, 210Bi dan 210Po.
Ilmiah
Emanasi radon dari tanah bervariasi menurut jenis tanah dan dengan kandungan uranium permukaan, sehingga konsentrasi radon di luar ruangan dapat digunakan untuk melacak massa udara hingga tingkat yang terbatas. Fakta ini telah dimanfaatkan oleh beberapa ilmuwan atmosfer (Badai radon). Karena kehilangan radon yang cepat ke udara dan peluruhan yang relatif cepat, radon digunakan dalam penelitian hidrologi yang mempelajari interaksi antara air tanah dan aliran air. Setiap konsentrasi radon yang signifikan dalam aliran air merupakan indikator yang baik bahwa ada input air tanah lokal.
Konsentrasi tanah radon telah digunakan dalam cara eksperimental untuk memetakan patahan geologis dekat bawah permukaan yang terkubur karena konsentrasi radon umumnya lebih tinggi di atas patahan. Demikian pula, radon telah digunakan secara terbatas dalam prospeksi gradien panas bumi.
Beberapa peneliti telah menyelidiki perubahan konsentrasi radon air tanah untuk prediksi gempa bumi. Peningkatan radon dicatat sebelum gempa bumi Tashkent 1966 dan Mindoro 1994. Radon memiliki waktu paruh sekitar 3,8 hari, yang berarti bahwa ia dapat ditemukan hanya sesaat setelah diproduksi dalam rantai peluruhan radioaktif. Untuk alasan ini, telah dihipotesiskan bahwa peningkatan konsentrasi radon disebabkan oleh pembentukan retakan baru di bawah tanah, yang memungkinkan peningkatan sirkulasi air tanah, membuang radon. Pembentukan retakan baru mungkin tidak masuk akal diasumsikan mendahului gempa bumi besar. Pada tahun 1970-an dan 1980-an, pengukuran ilmiah emisi radon di dekat patahan menemukan bahwa gempa sering terjadi tanpa sinyal radon, dan radon sering terdeteksi tanpa diikuti gempa. Ia kemudian ditolak oleh banyak orang sebagai indikator yang tidak dapat diandalkan. Pada tahun 2009, ia sedang diselidiki sebagai kemungkinan prekursor oleh NASA.
Radon dikenal sebagai polutan yang dipancarkan dari pembangkit listrik tenaga panas bumi karena hadir dalam material yang dipompa dari bawah tanah. Ia menyebar dengan cepat, dan tidak ada bahaya radiologis yang ditunjukkan dalam berbagai investigasi. Selain itu, sistem tipikal menginjeksi ulang material jauh di bawah tanah daripada melepaskannya di permukaan, sehingga dampak lingkungannya minimal. Namun, hal serupa dapat dikatakan tentang pelepasan sepele dari pengoperasian pembangkit listrik tenaga nuklir.
Pada tahun 1940-an dan 1950-an, radon digunakan untuk radiografi industri. Sumber sinar-X lain, yang tersedia setelah Perang Dunia II, dengan cepat menggantikan radon untuk aplikasi ini, karena biayanya yang lebih rendah dan memiliki bahaya radiasi alfa yang lebih kecil.
Risiko kesehatan
Di penambangan
Produk peluruhan radon-222 telah diklasifikasikan oleh Badan Penelitian Kanker Internasional sebagai karsinogenik bagi manusia, dan sebagai gas yang dapat dihirup, kanker paru-paru menjadi perhatian khusus bagi orang-orang yang terpapar radon tingkat tinggi secara terus-menerus. periode. Selama tahun 1940-an dan 1950-an, ketika standar keamanan yang membutuhkan ventilasi mahal di tambang tidak diterapkan secara luas, paparan radon dikaitkan dengan kanker paru-paru di antara penambang uranium dan bahan batuan keras lainnya yang tidak merokok di tempat yang sekarang menjadi Republik Ceko, dan kemudian di antara para penambang dari A.S. Barat Daya dan Australia Selatan. Meskipun bahaya ini diketahui pada awal 1950-an,bahaya pekerjaan ini tetap tidak dikelola dengan baik di banyak tambang sampai tahun 1970-an. Selama periode ini, beberapa pengusaha membuka bekas tambang uranium di A.S. untuk masyarakat umum dan mengiklankan dugaan manfaat kesehatan dari menghirup gas radon di bawah tanah. Manfaat kesehatan yang diklaim termasuk pereda nyeri, sinus, asma, dan artritis, tetapi hal ini terbukti salah dan pemerintah melarang iklan semacam itu pada tahun 1975.
Sejak saat itu, ventilasi dan langkah-langkah lain telah digunakan untuk mengurangi tingkat radon di sebagian besar tambang yang terus beroperasi terkena dampak. Dalam beberapa tahun terakhir, paparan tahunan rata-rata penambang uranium telah turun ke tingkat yang serupa dengan konsentrasi yang dihirup di beberapa rumah. Hal ini telah mengurangi risiko kanker akibat pekerjaan dari radon, meskipun masalah kesehatan mungkin tetap ada bagi mereka yang saat ini bekerja di tambang yang terkena dampak dan bagi mereka yang pernah bekerja di dalamnya di masa lalu. Karena risiko relatif untuk penambang telah menurun, demikian pula kemampuan untuk mendeteksi kelebihan risiko di antara populasi tersebut.
Residu dari pengolahan bijih uranium juga bisa menjadi sumber radon. Radon yang dihasilkan dari kandungan radium yang tinggi di tempat pembuangan terbuka dan kolam tailing dapat dengan mudah dilepaskan ke atmosfer dan memengaruhi orang yang tinggal di sekitarnya.
Selain kanker paru-paru, para peneliti berteori kemungkinan peningkatan risiko leukemia akibat paparan radon. Dukungan empiris dari studi populasi umum tidaklah konsisten, dan studi penambang uranium menemukan korelasi antara paparan radon dan leukemia limfositik kronis.
Penambang (serta pekerja transportasi penggilingan dan bijih) yang bekerja di industri uranium di A.S. antara tahun 1940-an dan 1971 mungkin memenuhi syarat untuk mendapatkan kompensasi berdasarkan UU Kompensasi Paparan Radiasi (RECA). Kerabat yang masih hidup juga dapat berlaku dalam kasus di mana orang yang sebelumnya bekerja telah meninggal dunia.
Tidak hanya tambang uranium yang terpengaruh oleh peningkatan kadar radon. Tambang batu bara khususnya juga terpengaruh karena batu bara mungkin mengandung lebih banyak uranium dan torium daripada tambang uranium yang beroperasi secara komersial.
Paparan tingkat domestik
Paparan yang terlalu lama terhadap konsentrasi radon yang lebih tinggi telah dikaitkan dengan peningkatan kanker paru-paru. Sejak tahun 1999, telah dilakukan penyelidikan di seluruh dunia tentang bagaimana konsentrasi radon diperkirakan. Di Amerika Serikat saja rata-rata telah tercatat setidaknya 40 Bq/meter kubik. Steck dkk. melakukan studi tentang variasi antara radon dalam ruangan dan luar ruangan di Iowa dan Minnesota. Radiasi yang lebih tinggi ditemukan di daerah berpenduduk daripada di daerah tidak berpenghuni di Amerika Tengah secara keseluruhan. Di beberapa wilayah Iowa barat laut dan Minnesota barat daya, konsentrasi radon luar ruangan melebihi konsentrasi radon dalam ruangan rata-rata nasional. Terlepas dari rata-rata di atas, angka Minnesota dan Iowa sangatlah dekat, terlepas dari jaraknya. Dosis radon yang akurat sangat dibutuhkan untuk lebih memahami masalah radon secara total pada suatu komunitas. Dapat dipahami bahwa keracunan radon memang menyebabkan kesehatan yang buruk, dan kanker paru-paru, namun dengan penelitian lebih lanjut, pengendalian dapat mengubah hasil emisi radon baik di dalam maupun di luar unit perumahan.
Paparan radon (kebanyakan anak/produk peluruhan radon) telah dikaitkan dengan kanker paru-paru dalam banyak studi kasus-kontrol yang dilakukan di A.S., Eropa, dan Tiongkok. Ada sekitar 21.000 kematian per tahun di A.S. (0,0063% dari populasi 333 juta) karena kanker paru-paru yang diinduksi radon. Di Slovenia, negara dengan konsentrasi radon yang tinggi, sekitar 120 orang (0,0057% dari populasi 2,11 juta) setiap tahunnya meninggal karena radon. Salah satu studi radon paling komprehensif yang dilakukan di A.S. oleh ahli epidemiologi R. William Field dan rekannya menemukan peningkatan risiko kanker paru-paru sebesar 50% bahkan pada paparan yang berkepanjangan pada tingkat tindakan EPA sebesar 4 pCi/L. Analisis gabungan Amerika Utara dan Eropa lebih lanjut mendukung temuan ini. Namun, diskusi tentang hasil yang berlawanan masih berlanjut, terutama studi kasus-kontrol retrospektif tahun 2008 tentang risiko kanker paru-paru yang menunjukkan pengurangan tingkat kanker secara substansial untuk konsentrasi radon antara 50 dan 123 Bq/m3.
Sebagian besar model paparan radon perumahan didasarkan pada studi penambang, dan perkiraan langsung dari risiko yang ditimbulkan pada pemilik rumah akan lebih diinginkan. Karena kesulitan mengukur risiko radon relatif terhadap merokok, model efeknya sering memanfaatkannya.
Radon telah dianggap sebagai penyebab utama kedua kanker paru-paru dan penyebab lingkungan utama kematian akibat kanker oleh EPA, dengan yang pertama adalah merokok. Yang lain telah mencapai kesimpulan serupa untuk Britania Raya dan Prancis. Paparan radon di rumah dan kantor dapat timbul dari formasi batuan bawah permukaan tertentu, dan juga dari bahan bangunan tertentu (misalnya, beberapa granit). Risiko paparan radon terbesar muncul pada bangunan yang kedap udara, berventilasi tidak memadai, dan memiliki kebocoran fondasi yang memungkinkan udara dari tanah masuk ke ruang bawah tanah dan ruang hunian.
Toron (220Rn) diukur pada konsentrasi yang relatif tinggi pada bangunan dengan arsitektur tanah, seperti rumah setengah kayu tradisional dan rumah modern dengan pelapis dinding tanah liat. Karena waktu paruhnya yang pendek, toron hanya terdapat di dekat permukaan tanah sebagai sumbernya sedangkan turunannya dapat ditemukan di seluruh udara dalam ruangan bangunan tersebut. Oleh karena itu, paparan radiasi terjadi di setiap lokasi di dalam rumah tersebut. Di tempat tinggal yang berbeda dengan arsitektur tanah di Jerman, sebuah penelitian menemukan dosis radiasi internal tahunan akibat menghirup toron dan turunannya hingga beberapa mili-Sievert.
Pada tahun 2009, WHO mempresentasikan tingkat referensi yang direkomendasikan (tingkat referensi nasional), 100 Bq/m3, untuk radon di tempat tinggal. Rekomendasi tersebut juga menyatakan bahwa jika hal ini tidak memungkinkan, 300 Bq/m3 harus dipilih sebagai level tertinggi. Tingkat referensi nasional seharusnya tidak menjadi batas, tetapi harus mewakili konsentrasi radon rata-rata tahunan maksimum yang dapat diterima di sebuah hunian.
Konsentrasi radon yang dapat ditindaklanjuti di rumah bervariasi tergantung pada organisasi yang melakukan rekomendasi, misalnya, EPA mendorong agar tindakan diambil pada konsentrasi serendah 74 Bq/m3 (2 pCi/L), dan Uni Eropa merekomendasikan agar tindakan diambil ketika konsentrasi mencapai 400 Bq/m3 (11 pCi/L) untuk rumah lama dan 200 Bq/m3 (5 pCi/L) untuk rumah baru. Pada 8 Juli 2010, Badan Perlindungan Kesehatan Britania Raya mengeluarkan saran baru yang menetapkan "Tingkat Target" sebesar 100 Bq/m3 sambil mempertahankan "Tingkat Tindakan" sebesar 200 Bq/m3. Tingkat serupa (seperti di Britania Raya) diterbitkan oleh Otoritas Keamanan Nuklir dan Radiasi Norwegia (DSA) dengan batas maksimum untuk sekolah, taman kanak-kanak, dan tempat tinggal baru ditetapkan sebesar 200 Bq/m3, di mana 100 Bq/m3 ditetapkan sebagai tingkat tindakan. Di semua perumahan baru, tindakan pencegahan harus diambil terhadap akumulasi radon.
Inhalasi dan merokok
Hasil dari studi epidemiologi menunjukkan bahwa risiko kanker paru-paru meningkat dengan paparan radon perumahan. Contoh sumber kesalahan yang terkenal adalah merokok, faktor risiko utama kanker paru-paru. Di A.S., merokok sigaret diperkirakan menyebabkan 80% sampai 90% dari semua kanker paru-paru.
Menurut EPA, risiko kanker paru-paru bagi perokok sangat signifikan karena efek sinergis radon dan merokok. Untuk populasi ini sekitar 62 orang dari total 1.000 akan meninggal karena kanker paru-paru dibandingkan dengan 7 orang dari total 1.000 orang yang tidak pernah merokok. Tidak dapat dikesampingkan bahwa risiko nonperokok terutama disebabkan oleh efek radon.
Radon, seperti faktor risiko eksternal lain yang diketahui atau dicurigai untuk kanker paru-paru, merupakan ancaman bagi perokok dan mantan perokok. Hal ini ditunjukkan oleh studi penyatuan Eropa. Sebuah komentar untuk studi penyatuan tersebut menyatakan: "tidaklah tepat untuk berbicara hanya tentang risiko radon di rumah. Risikonya adalah dari merokok, ditambah dengan efek sinergis radon untuk perokok. Tanpa merokok, efeknya tampaknya sangat kecil, seperti hal yang tidak penting."
Menurut studi penyatuan Eropa, ada perbedaan risiko subtipe histologis kanker paru-paru dan paparan radon. Karsinoma paru-paru sel kecil, yang berkorelasi tinggi dengan merokok, memiliki risiko lebih tinggi setelah paparan radon. Untuk subtipe histologis lainnya seperti adenokarsinoma, jenis yang terutama menyerang nonperokok, risiko radon tampaknya lebih rendah.
Sebuah studi radiasi dari radioterapi pasca mastektomi menunjukkan bahwa model sederhana yang sebelumnya digunakan untuk menilai risiko gabungan dan terpisah dari radiasi dan merokok perlu dikembangkan. Hal ini juga didukung oleh pembahasan baru tentang metode perhitungan model tanpa ambang linier, yang secara rutin telah digunakan.
Sebuah studi dari tahun 2001, yang melibatkan 436 nonperokok dan kelompok kontrol 1649 nonperokok, menunjukkan bahwa paparan radon meningkatkan risiko kanker paru-paru pada nonperokok. Kelompok yang terpapar asap tembakau di dalam rumah tampaknya memiliki risiko yang jauh lebih tinggi, sedangkan mereka yang tidak terpapar asap rokok pasif tidak menunjukkan peningkatan risiko dengan meningkatnya paparan radon.
Ingesti
Bila tertelan, efek radon tidaklah diketahui, meskipun penelitian telah menemukan bahwa waktu paruh biologisnya berkisar antara 30 hingga 70 menit, dengan penghilangan 90% dalam 100 menit. Pada tahun 1999, Dewan Riset Nasional A.S. menyelidiki masalah radon dalam air minum. Risiko yang terkait dengan ingesti dianggap hampir dapat diabaikan. Air dari sumber bawah tanah mungkin mengandung radon dalam jumlah yang signifikan tergantung pada kondisi batuan dan tanah di sekitarnya, sedangkan sumber permukaan umumnya tidak.
Efek laut dari radon
Pentingnya memahami fluks 222Rn dari lautan, adalah untuk mengetahui bahwa peningkatan penggunaan radon juga bersirkulasi dan meningkat di atmosfer. Konsentrasi permukaan laut memiliki pertukaran di atmosfer, menyebabkan 222Rn meningkat melalui antarmuka udara-laut. Meskipun area yang diuji sangat dangkal, pengukuran tambahan di berbagai rezim pesisir akan membantu menentukan sifat 222Rn yang diamati. Selain tertelan melalui air minum, radon juga dilepaskan dari air saat suhu dinaikkan, tekanan diturunkan, dan saat air diangin-anginkan. Kondisi optimal untuk pelepasan dan paparan radon terjadi selama mandi. Air dengan konsentrasi radon 104 pCi/L dapat meningkatkan konsentrasi radon di udara dalam ruangan sebesar 1 pCi/L dalam kondisi normal.
Pengujian dan mitigasi
Ada beberapa tes yang relatif sederhana untuk gas radon. Di beberapa negara, pengujian ini dilakukan secara metodis di area dengan bahaya sistematik yang diketahui. Perangkat pendeteksi radon tersedia secara komersial. Detektor radon digital memberikan pengukuran berkelanjutan yang memberikan pembacaan rata-rata harian, mingguan, jangka pendek, dan jangka panjang melalui tampilan digital. Perangkat uji radon jangka pendek yang digunakan untuk tujuan penyaringan awal tidaklah mahal, bahkan dalam beberapa kasus dapat menjadi gratis. Ada protokol penting untuk melakukan tes radon jangka pendek dan sangat penting untuk diikuti dengan ketat. Kit tersebut mencakup kolektor yang digantung pengguna di lantai rumah yang dapat dihuni paling bawah selama dua hingga tujuh hari. Pengguna kemudian mengirim kolektor ke laboratorium untuk dianalisis. Kit jangka panjang, mengambil koleksi hingga satu tahun atau lebih, juga tersedia. Kit uji lahan terbuka dapat menguji emisi radon dari lahan sebelum konstruksi dimulai. Konsentrasi radon dapat bervariasi setiap hari, dan perkiraan paparan radon yang akurat memerlukan pengukuran radon rata-rata jangka panjang di tempat di mana seseorang menghabiskan banyak waktu.
Tingkat radon berfluktuasi secara alami, karena faktor-faktor seperti kondisi cuaca sementara, jadi tes awal mungkin bukan penilaian yang akurat terhadap tingkat radon rata-rata rumah. Tingkat radon mencapai maksimum selama bagian terdingin hari ketika perbedaan tekanan paling besar. Oleh karena itu, hasil yang tinggi (lebih dari 4 pCi/L) membenarkan pengujian ulang sebelum melakukan proyek pengurangan yang lebih mahal. Pengukuran antara 4 dan 10 pCi/L memerlukan uji radon jangka panjang. Pengukuran di atas 10 pCi/L hanya memerlukan pengujian jangka pendek lainnya sehingga tindakan pengurangan tidak terlalu tertunda. Pembeli lahan yasan disarankan untuk menunda atau menolak pembelian jika penjual belum berhasil mengurangi radon menjadi 4 pCi/L atau kurang.
Karena waktu paruh radon hanya 3,8 hari, menghilangkan atau mengisolasi sumbernya akan sangat mengurangi bahaya dalam beberapa minggu. Metode lain untuk mengurangi tingkat radon adalah memodifikasi ventilasi bangunan. Umumnya, konsentrasi radon dalam ruangan meningkat seiring dengan penurunan tingkat ventilasi. Di tempat yang berventilasi baik, konsentrasi radon cenderung sejajar dengan nilai di luar ruangan (biasanya 10 Bq/m3, berkisar antara 1 hingga 100 Bq/m3).
Empat cara utama untuk mengurangi jumlah radon yang terakumulasi dalam sebuah rumah adalah:
- Depresurisasi sub-lempengan (pengisapan tanah) dengan meningkatkan ventilasi di bawah lantai;
- Memperbaiki ventilasi rumah dan menghindari pengangkutan radon dari ruang bawah tanah ke ruang tamu;
- Memasang sistem bah radon di ruang bawah tanah;
- Memasang tekanan positif atau sistem ventilasi suplai positif.
Menurut EPA, metode untuk mengurangi radon "...terutama digunakan adalah sistem pipa ventilasi dan kipas, yang menarik radon dari bawah rumah dan melampiaskannya ke luar", yang juga disebut depresurisasi sub-lempengan, depresurisasi tanah aktif, atau pengisapan tanah. Umumnya radon dalam ruangan dapat dikurangi dengan depresurisasi sub-lempengan dan membuang udara sarat radon tersebut ke luar, jauh dari jendela dan bukaan bangunan lainnya. "EPA umumnya merekomendasikan metode yang mencegah masuknya radon. Pengisapan tanah, misalnya, mencegah radon memasuki rumah Anda dengan menarik radon dari bawah rumah dan mengeluarkannya melalui pipa ke udara di atas rumah di mana ia dengan cepat diencerkan" dan "EPA tidak merekomendasikan penggunaan penyegelan saja untuk mengurangi radon karena, dengan sendirinya, penyegelan belum terbukti menurunkan kadar radon secara signifikan atau konsisten".
Sistem ventilasi bertekanan positif dapat dikombinasikan dengan penukar panas untuk memulihkan energi dalam proses pertukaran udara dengan luar, dan hanya membuang udara ruang bawah tanah ke luar belum tentu merupakan solusi yang layak karena hal ini sebenarnya dapat menarik gas radon ke dalam hunian. Rumah yang dibangun dengan ruang merangkak dapat memanfaatkan kolektor radon yang dipasang di bawah "penghalang radon" (selembar plastik yang menutupi ruang merangkak). Untuk ruang merangkak, EPA menyatakan "Metode yang efektif untuk mengurangi tingkat radon di rumah dengan ruang merangkak adalah menutupi lantai dengan lembaran plastik kepadatan tinggi. Pipa ventilasi dan kipas digunakan untuk menarik radon dari bawah lembaran dan melampiaskannya ke luar. Bentuk pengisapan tanah ini disebut pengisapan submembran, dan bila diterapkan dengan benar adalah cara yang paling efektif untuk mengurangi tingkat radon di rumah dengan ruang merangkak."
Lihat pula
- Proyek Radon Internasional
- Sel Lucas
- Halo pleokrois (alias: Radiohalo)
- UU Kompensasi Paparan Radiasi
Pranala luar
- (Inggris) Radon dan publikasi radon di Badan Perlindungan Lingkungan Amerika Serikat
- (Inggris) Layanan Program Radon Nasional diselenggarakan oleh Universitas Negeri Kansas
- (Inggris) Peta radon Britania Raya
- (Inggris) Informasi Radon dari Kesehatan Masyarakat Britania Raya
- (Inggris) Pertanyaan Yang Sering Diajukan Tentang Radon di Dewan Keamanan Nasional
- (Inggris) Radon di The Periodic Table of Videos (Universitas Nottingham)
- (Inggris) Radon dan Kesehatan Paru-Paru dari Asosiasi Paru-Paru Amerika
- (Inggris) Dampak Radon pada kesehatan Anda – Asosiasi Paru-Paru
- (Inggris) The Geologi Radon, James K. Otton, Linda C.S. Gundersen, dan R. Randall Schumann
- (Inggris) Panduan Pembeli dan Penjual Rumah untuk Radon Sebuah artikel oleh Asosiasi Internasional Inspektur Rumah Bersertifikat (InterNACHI)
- (Inggris) Profil Toksikologis untuk Radon, Draf Komentar Publik, Badan Zat Beracun dan Pendaftaran Penyakit, September 2008
- (Inggris) Efek Kesehatan Paparan Radon: BEIR VI. Komite Risiko Kesehatan Paparan Radon (BEIR VI), Dewan Riset Nasional tersedia secara daring
- (Inggris) UNSCEAR 2000 Laporan ke Majelis Umum, dengan lampiran ilmiah: Lampiran B: Paparan dari sumber radiasi alami.
- (Inggris) Haruskah Anda mengukur konsentrasi radon di rumah Anda?, Phillip N. Price, Andrew Gelman, dalam Statistics: A Guide to the Unknown, Januari 2004.
- (Inggris) Radon di Rumah- Pembunuh Tak Terlihat Seberapa serius tingkat radon yang tinggi di rumah? Kevin Vitali
| (besar) | ||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||
| Umum | |
|---|---|
| Perpustakaan nasional | |
| Lain-lain | |